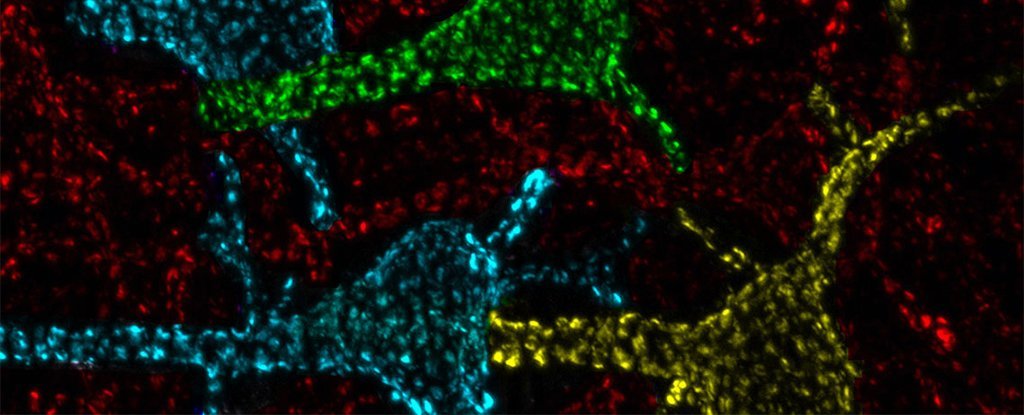
Die Rolle bestimmter Proteinklumpen auf der Oberfläche von Gehirnzellen in der Seepferdchen – der Teil des Gehirns, der eine Schlüsselrolle beim Lernen und Gedächtnis spielt – fasziniert Wissenschaftler seit mehreren Jahrzehnten. Aber dieses besondere biologische Rätsel hätte endlich gelöst werden können.
Es war Bereits bekannt dass eine Störung dieser Cluster zu schweren neurologischen Störungen führen könnte, aber es war nicht bekannt, warum. Eine neue Studie legt nahe, dass Cluster Kalzium-Signalisierungs-„Hot Spots“ sind, die für die Aktivierung der Genexpression unerlässlich sind.
Hotspot-Proteine scheinen ungewöhnlich groß zu sein Ionenkanäle, Gateways, die es geladenen Atomen ermöglichen, in die Zelle einzudringen. Der Austausch dieser Ionen ist eine der wichtigsten Möglichkeiten, wie Zellen wie Neuronen miteinander kommunizieren – indem sie ein Signal wie eine Berührung oder Gedankenmuster von einer Zellgruppe an eine andere weitergeben, damit wir sie bewusst verarbeiten können.
„Wir wissen schon lange um die Funktion anderer Arten von Ionenkanalclustern, zum Beispiel in Synapsen“, sagt der Physiologe James Trimmer von der University of California, Davis.
„Allerdings war keine Rolle bekannt, die diese viel größeren Strukturen am Zellkörper für die Physiologie des Neurons spielten.“
Trimmer und seine Kollegen hatten zuvor mehrere Kanäle durch diese Proteincluster entdeckt, von denen einige nur Kaliumionen durch eine Zellmembran passieren lassen, während andere nur zu Kalziumionen gehen.
Mit Experimenten an Nagetierneuronen entkoppelte das Team Kalium- und Kalziumkanäle, die Fragmente von Proteinen enthalten, die aneinander binden. Sie überfluteten Neuronen mit Fragmenten von Köder-Kaliumkanälen, an denen sich die Kalziumkanäle festhielten, bevor sie sich von den Klumpen der Zellmembranen lösten.
Es hat sich gezeigt, dass dies die Verbindung zwischen der elektrischen Signalübertragung in neuronalen Zellen und der Genexpression trennt, einem kritischen Prozess in einem ordnungsgemäß funktionierenden Gehirn, der als Erregungs-Transkriptions-Kopplung bezeichnet wird.
„Es gibt viele verschiedene Kalziumkanäle, aber die spezielle Art von Kalziumkanal, die in diesen Clustern gefunden wird, ist notwendig, um Veränderungen der elektrischen Aktivität in Veränderungen der Genexpression umzuwandeln.“ sagte Rasenmäher.
„Wir haben herausgefunden, dass, wenn Sie die Kalzium-Signalproteine in diesen ungewöhnlichen Clustern stören, Sie die Erregungs-Transkriptions-Kopplung im Wesentlichen eliminieren, die für das Lernen, das Gedächtnis und andere Formen der neuronalen Plastizität unerlässlich ist.“
Die Kalziumsignalisierung ist gut untersucht in Dendriten, die ausgedehnten Teile von Neuronen, die Nachrichten zwischen Zellen verarbeiten, aber bisher wurde nicht viel darüber geforscht, wie die Kalziumsignalisierung im Zellkörper der Neuronen funktionieren könnte.
Wie die Forscher erklären, sind diese Neuronencluster „hoch konserviert“, was bedeutet, dass sie von evolutionären Prozessen relativ unberührt geblieben sind. Dies unterstreicht ihre Bedeutung bei Wirbellosen und Wirbeltieren, einschließlich des Menschen. Bis zu 100 Cluster können an eine einzelne Zelle angehängt werden.
Wissenschaftler machen ständig neue Entdeckungen über die Funktionsweise des Gehirns, und jeder weitere Blick in dieses komplexeste und fortschrittlichste Organ kann helfen, Probleme mit seiner Funktionsweise zu lösen – oder sie von vornherein zu verhindern.
„Wir stehen erst am Anfang, die Bedeutung dieser Signalgebung zu verstehen, aber diese neuen Erkenntnisse könnten Informationen liefern, die die weitere Erforschung ihrer Rolle in der Gehirnfunktion und möglicherweise die Entwicklung neuer therapeutischer Klassen prägen könnten“, sagte Rasenmäher.
Die Studie wurde veröffentlicht in PNAS.

Freiberuflicher Alkoholiker. Begeisterter Webfanatiker. Subtil charmanter Zombie-Junkie. Ergebener Leser.
You may also like
-
Österreichische Gletscher ziehen sich „mehr denn je“ zurück: Messung
-
Von der NASA ins All geschickte Samen, Forstdienst kehrt zur Erde zurück und erschafft eine neue Generation von „Mondbäumen“
-
Wie die Vereinigten Arabischen Emirate ein Raumschiff zum Mars schickten – beim ersten Versuch
-
Die seltensten Wolken der Welt erscheinen über der Bucht von San Francisco
-
2023: Massive Menschenmassen in Abuja, als APC-Frauen und -Jugendliche eine Kundgebung für die Präsidentschaft von Tinubu/Shettima abhalten