Neue Methoden ermöglichen es Wissenschaftlern am IST Austria, tief in Zellen zu schauen: Hochauflösende Bilder von gefrorenen Zellen zeigen Strukturen, die bisher nicht erraten werden konnten.
Die Zellen unseres Körpers sind in Bewegung. Einige wandern von A nach B, um Wunden zu heilen oder Krankheitserreger zu bekämpfen. Sie tun dies mit kleinen „Füßen“ an der Vorderkante von wandernden Zellen, sogenannten Lamellipoden. Diese dünnen Verlängerungen werden nach vorne gedrückt und binden an die Oberfläche, während der Rest der Zelle mitgezogen wird. In diesen Füßen befindet sich ein dichtes Netzwerk von miteinander verflochtenen Proteinfäden, die als Aktinfilamente bezeichnet werden und das Zytoskelett der Zelle bilden. Bisher war nicht bekannt, wie der Arp2 / 3-Komplex, eine Anordnung von sieben Proteinen, die für die Zellmotilität von zentraler Bedeutung sind, neue Aktinfilamente aus bereits vorhandenen Filamenten keimt und so dichte und verzweigte Netzwerke erzeugt, die die Kräfte bereitstellen. für die Zelle notwendige Protrusiva.
Schwierige Entscheidungen
Bisher mussten Wissenschaftler entscheiden, wann sie die Struktur des Arp2 / 3-Komplexes analysieren wollten: Eine Möglichkeit bestand darin, ihn isoliert zu untersuchen, wobei sich der Proteinkomplex in einer inaktiven Konformation befindet und daher nicht zu verstehen ist, wie der Netzwerk gebildet wird. Um jedoch vollständig aktiviert zu werden, muss der Arp2 / 3-Komplex an Aktinfilamente gebunden sein. Dies erfordert die Verwendung einer Methode namens Elektronentomographie, die auf Kosten einer erheblich geringeren Auflösung geht. „Frühere Elektronentomographiedaten von Arp2 / 3-Komplexen, die in einer Reagenzglasumgebung an Aktinfilamente gebunden waren, waren zu ungenau, sodass nicht eindeutig gesagt werden konnte, wo sich die einzelnen Elemente des Komplexes befinden sollten“, erklärt Florian Fäßler, Postdoc in der Gruppe von Professor Florian Schur vom IST Austria.
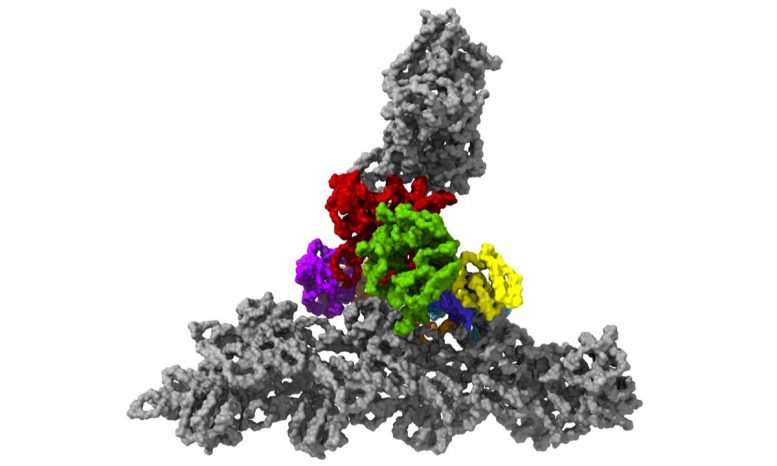
Der Arp2 / 3-Proteinkomplex mit seinen sieben Untereinheiten (gefärbt), während er an Aktinfilamente bindet (grau). Bildnachweis: © Florian Fäßler, IST Österreich
Seit mehr als zwei Jahren sucht er nach einer Möglichkeit, den Proteinkomplex in seiner natürlichen Umgebung darzustellen, damit einzelne Strukturen genau analysiert werden können. Jetzt ist es ihm gelungen. Er stellte sich den Komplex in den Lamellipoden von Mauszellen in seiner aktiven aktingebundenen Konformation vor. „Wir dachten, okay, wir gehen in die Zelle, wo die Umgebung viel komplexer ist, weil es nicht nur den Proteinkomplex und die Aktinfilamente gibt, sondern auch alle möglichen anderen Dinge. . Nur so konnten wir dieses Netzwerk aufrechterhalten und seine Struktur bestimmen “, erklärt der Molekularbiologe Florian Schur.
Schockgefrorene Zellen
Möglich wurde dies durch Temperaturen von minus 196 Grad Celsius. Innerhalb von Millisekunden froren die Forscher die Proben ein – zu schnell, um Eiskristalle zu bilden, die die Feinstrukturen der Zelle zerstört hätten. Anschließend verwendeten sie eines der leistungsstärksten verfügbaren kryoelektronischen Mikroskope – und das einzige seiner Art in Österreich -, um Zellen mithilfe der Kryoelektronentomographie aus verschiedenen Winkeln abzubilden. Dabei sammelte das Team genügend Daten für die 3D-Rekonstruktion von mehr als 10.000 Arp2 / 3-Komplexen in ihrem aktiven Zustand. In Kombination mit fortschrittlicher Bildverarbeitung erstellten sie dann ein 3D-Modell des Arp2 / 3-Komplexes mit einer Auflösung von weniger als einem Nanometer. Zum Vergleich: Menschenhaar ist etwa 50.000 Nanometer dick. „Wir sind jetzt in der Lage, die Struktur des Proteinkomplexes und seiner Untereinheiten ziemlich genau zu beschreiben und wie sie das Netzwerk von Aktinfilamenten innerhalb der Lamellipodien zuvor lebender Zellen bilden“, erklärt Florian Fäßler. „Vor fünf Jahren hätte wahrscheinlich niemand gedacht, dass dies möglich ist“, fügt Schur hinzu.
An der Grenze
Aufgrund der fortschrittlichen Methodik konnte das Team ein früheres Modell widerlegen, das viel größere zonale Verbindungen zwischen dem Arp2 / 3-Komplex und Aktinfilamenten annahm. Wissenschaftler haben jedoch andere Aspekte der Regulation dieses Komplexes und der Bildung neuer Aktinfilamente bestätigt. Mit diesem Wissen können andere Wissenschaftler nun die Regulation und Aktivität dieses wichtigen Proteinkomplexes in seinen vielfältigen Rollen über die Zellmotilität und die Krankheitsentwicklung hinaus besser verstehen. „Wir haben jetzt so komplexe Stichproben in Bezug auf Methodik und Auflösung so weit wie möglich gebracht. Mit der aktuellen Entschließung haben wir neues biologisches Wissen erworben, aber es war auch ein methodischer Fortschritt zu zeigen: Es ist möglich “, schwärmt Schur. Florian Fäßler möchte nun die Methode zur Visualisierung anderer Proteine weiter verbessern und untersuchen, wie die Methode es uns ermöglicht, in eine Zelle zu sehen. „Wir fangen gerade erst an, das volle Potenzial der kryoelektronischen Tomographie auszuschöpfen“, sagt Schur.
Bildnachweis: „Kryonische Tomographiestruktur des Arp2 / 3-Komplexes in Zellen enthüllt neues Wissen über Zweigstellen“ von Florian Fäßler, Georgi Dimchev, Victor-Valentin Hodirnau, William Wan und Florian KM Schur, 22. Dezember 2020, Naturkommunikation.
DOI: 10.1038 / s41467-020-20286-x
Finanzierung: Österreichischer Wissenschaftsfonds (FWF), Georgi Dimchev, Florian Schur.

Freiberuflicher Alkoholiker. Begeisterter Webfanatiker. Subtil charmanter Zombie-Junkie. Ergebener Leser.
You may also like
-
Österreichische Gletscher ziehen sich „mehr denn je“ zurück: Messung
-
Von der NASA ins All geschickte Samen, Forstdienst kehrt zur Erde zurück und erschafft eine neue Generation von „Mondbäumen“
-
Wie die Vereinigten Arabischen Emirate ein Raumschiff zum Mars schickten – beim ersten Versuch
-
Die seltensten Wolken der Welt erscheinen über der Bucht von San Francisco
-
2023: Massive Menschenmassen in Abuja, als APC-Frauen und -Jugendliche eine Kundgebung für die Präsidentschaft von Tinubu/Shettima abhalten

